- HOME
- 支援利用者・支援者インタビュー
- 深澤 有吾
支援利用者・支援者インタビュー
ナノの視野を得て、
研究に新しい見方と飛躍を
〜膜分子を中心に、生体分子の発現分布と超微細形態の解析を支援〜
深澤 有吾
福井大学医学部・脳形態機能学(解剖学2) 教授
セミの羽化に感じた不思議さが原点
深澤有吾・福井大学医学部教授にとって、顕微鏡は生き物の不思議さに迫る道具だ。子どものころ夢中になっていた昆虫採集が、そこに至るきっかけだった。
「捕まえてきたセミの幼虫が羽化する様子がとても不思議でした」。誰かに教えてもらったわけでもないのに、セミの幼虫は、ある日地中から地表に出てくる。そして木を見つけて垂直に登り、羽化に適した姿勢を確保する。人間が同じようなことをやろうとすれば手順を学ばないとできないのに、セミは全く教わることなくできてしまう。
その仕組みは、昆虫のどこに隠されているのだろうか。大学では生物学を学び、配属された研究室では、魚類や哺乳類の臓器の発達を研究した。臓器や組織を切片にして光学顕微鏡で観察する。「体の中の仕組みや構造、分子の分布を調べることで、そこでどんなことが起こっているのかがわかる。顕微鏡を使って調べるという方法に惹きつけられました」

マウスの生殖系の発達とがん化をテーマに博士号を取得。ポスドクでは、脳の大事な機能の一つである「記憶」の研究に移った。シナプスと呼ばれる1μmより小さな構造を詳しく調べたいが、光学顕微鏡の解像度では十分でない。
「そこでどうしても電子顕微鏡が必要になってきたので、大学院生時代にお世話になった先生に依頼して、写真を撮ってもらっていました。ただ当時は、電子顕微鏡は、作法に厳しく技術習得に時間がかかるので、学ぶことを躊躇してしまいがちな実験技法の一つで、自分が行うより、専門家に頼んだ方が良いと思っていました」
自分の手を使って電子顕微鏡を動かし、あるいは電子顕微鏡で見えるように試料を調整して研究を始めたのは、ポスドクを終え生理学研究所の助手(現助教)になってからだ。
SDS-FRL法でシナプスの世界をナノで定量的に計測する
生理研で取り組んだのは、凍結割断レプリカ免疫電子顕微鏡法(SDS-FRL法)と呼ばれる方法を、脳組織の研究に使えるように発展させることだった(図1)。高感度・高分解能で、タンパク質などの生体分子の分布の様子などを調べるのが狙いだった。
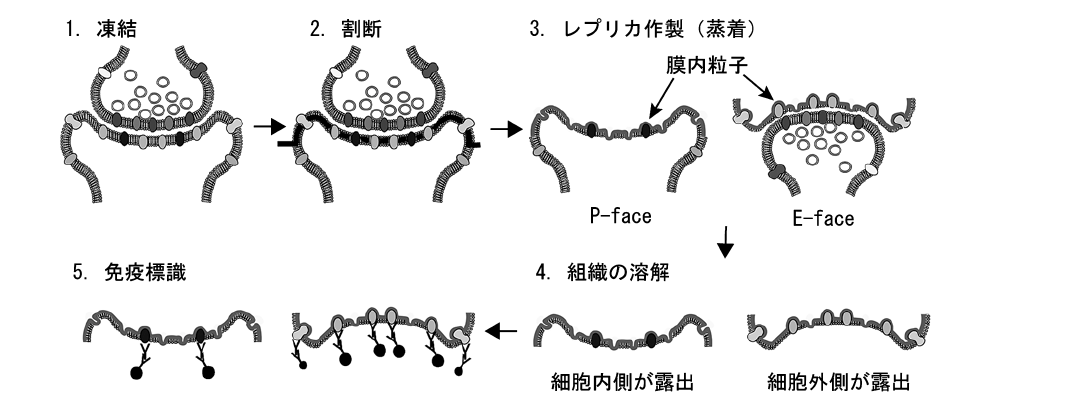
図1 SDSーFEL法の原理
固定、或いは無固定の組織を急速凍結し(1)、低温下で割断すると脂質2重膜の疎水性面で頻繁に割断が起こる(2,太線)。割断により暴露された膜内面に薄い炭素膜を蒸着後、プラチナを蒸着して膜の凹凸情報を複製し、最後に炭素を蒸着することで細胞や組織の複製膜(レプリカ)を作製する(3)。SDS溶液中で組織を溶解除去した後(4)、免疫金標識抗体を用いて目的分子を標識し(5)、電子顕微鏡下で金標識の分布を観察する。P-faceに分配された目的分子は、細胞内ドメインを認識する抗体で、E-faceに分配された目的分子は、細胞外ドメインを認識する抗体でのみ検出可能である。
以下のような手順で進める。
1)脳組織を凍結してから割断し、その表面に白金とカーボンを蒸着して複製膜(レプリカ)を作る。
2)レプリカに補足された分子(タンパク質など)だけが残るように、ほかの組織をSDS(界面活性剤)で洗い流す。
3)特定の分子だけに結合する抗体などを用いて、その分子が存在する量や、分布の様子を調べる。
SDS-FRL法は、もともとは1990年代に培養細胞を対象に開発された方法だ。脳の組織は、培養細胞より細胞の種類や形が多様だ。そして脳に存在する神経細胞は他の細胞に比べると、小さなパーツが複雑に組み合わされて作られている。しかも神経細胞どうしの接続部であるシナプスは、一個の神経細胞に数千個から数万個もある。
特に難しいのは、SDS-FRL法で観察したときに、どの細胞のどの部分を見ているか特定することだった。ねらった細胞だけが持っている特有の分子を目印にすることで、目的の細胞のどこを観察しているのか、確かめられるようにした。
(図2)は、SDS-FRL法を使って脳内の分子分布について最初に報告した論文の画像だ(スケールバーは500nm、1μmの半分)。大きい黒い粒、小さい粒は、それぞれ別々のタンパク質と結びついている金の粒子だ。この画像から、シナプス内のどこに有るのかが分からなかったタンパク質分子が、限られた場所にかたまって存在している様子が、初めて明らかになった。

図2 SDS-FRL法を使って最初に報告された論文(Hagiwara et al. 2005)に掲載された画像。大きい黒い粒、小さい粒は、それぞれ別々のタンパク質と結びついている金の粒子。シナプス全体にあると思われていたタンパク質分子が、限られた場所にかたまって存在している様子が明らかだ。スケールバーは500 nm(1 mmの2000分の1)。
「研究者の醍醐味は、多くの人が知りたいと思っていたことを、自分が世界で最初に見た、最初にわかった、そんな興奮する瞬間を味わえることでしょう」
分子を検出する感度が高いことも確かめ、学習や記憶で、シナプスの分子の数がどう変化するかなどを高分解能で定量測定できる技術として、注目されるようになった。
被支援者と一緒に観察して、一緒にわくわくしたい
2014年に福井大医学部の教授に就任。分子分布・微細形態・神経回路の視点から脳の謎を解き明かそうとしている。
自分の関心で進めるテーマだけでなく、最近の業績の3分の1強は、先端バイオイメージング支援プラットフォーム(ABiS)の支援にかかわるものだ。
「残り3分の2は、逆に他の人から助けてもらった研究になります。複数の先端技術を、一つのラボで維持するのは難しい。それぞれ特化した、先端的な技術を持つ研究者が協力して、自分の得意なところで他の研究者を手助けしたり、あるいは逆に他の人の手を借りたりして、そして必要に応じて組む相手も変えて研究するのが効率的です」

ポスドク時代に気づいたのは、一つの作業仮説に先端技術を組み合わせて研究を進めることで、より確度が高い、インパクトのある、後世に残る知識の発見になるということだ。先端技術を持っているラボが他の研究を助けることが、日本の研究をよりアピーリングにするし、またそうすることによって人類共通の財産を生み出す。だから他の研究者を先端技術で支援することは、とても重要だと考えて、ABiSの支援者に加わった。
SDS-FRL法以外の方法も使った支援もしている。原因や治療法が不明な慢性痛である「神経障害性疼痛」を引き起こすスイッチ役のタンパク質を山梨大などのグループが発見した研究では、包埋前(preembedding)免疫電子顕微鏡法で、脳のグリア細胞に発現しているそのタンパク質の分布を、定量的に解析して支援した。この成果はJournal of Experimental Medicine のオンライン版で2022年3月24日に発表された。
「ABiSでは目的にあわせて、自分たちの持つ技術の中で最適なものを支援に用いています。また、自分の研究では神経細胞を主に扱っているので、グリア細胞の研究者という、普通の共同研究なら組む機会が少ない領域から来た支援の申請を、自分の技術で解明していくのは面白くて、自分の研究にも重要なヒントが得られます」
支援の際には、試料を送ってもらって画像を返す方法だけでなく、被支援者に福井に来ていただいてご自分で電子顕微鏡を触ってもらい、解析の全体を体験してもらえるように心がけている。後者の「手を動かしてもらうタイプ」が約8割を占める。

「何十年も脳を研究している人でも、初めて電子顕微鏡を自分で使って、脳の中の緻密さや、細胞一個一個がどれだけ小さいのか体験してびっくりしている姿を見ると、面白いなあと感じます。研究者というのは、お互いに新しいものを見て感動することがしたくてやっているような仕事なので、そういう場を提供できたこと自体が、楽しいし、喜びを感じるんですよ」
電子顕微鏡支援班は総勢10人。3次元構造解析やクライオ電子顕微鏡を得意とする人、植物の観察に強い人など多彩な陣容だ。支援班の中でも、それぞれのチームの若手が行き来してお互いの技術を学ぶなど、研鑽を重ねている。
深澤氏は「最先端の電子顕微鏡技術で、ご自身の研究にぜひ飛躍を、そして新しい見方を加えてください」と呼びかけている。
(2022年6月1日インタビュー)
*感染対策を行い、取材・撮影を行いました。
 深澤 有吾 (ふかざわ・ゆうご)
深澤 有吾 (ふかざわ・ゆうご)
福井大学医学部・脳形態機能学(解剖学2)
教授
神奈川県出身。1988年3月 横浜市立大学文理学部・生物学科卒業。1997年3月 横浜市立大学・大学院総合理学研究科修了。博士(理学)取得。同年4月 三菱化学生命科学研究所 特別研究員。2001年9月 岡崎統合バイオサイエンスセンター 助手、2003年4月 生理学研究所・脳形態解析研究部門 助教。2011年9月 名古屋大学大学院・医学系研究科 准教授を経て、2014年5 月より現職。
支援利用者インタビュー
【イベントお知らせ】📣第48回日本分子生物学会年会へ4プラットフォームで出展します。https://t.co/FrBra9FGNE
— 生命科学連携推進協議会 (@platform_imsut) November 13, 2025
📌日時:12/3~12/5 (11:00~19:00)
📌会場:パシフィコ横浜 展示ホール(ブースNo.97)
https://t.co/iOpWRf8A0o
是非お立ち寄りください。(科研費研究支援説明など) pic.twitter.com/PYX7PGF8Vv







