- HOME
- 支援利用者・支援者インタビュー
- 大森 義裕
支援利用者・支援者インタビュー
全ゲノム解読で深まるキンギョの魅力
〜次世代DNAシーケンサーの力で全ゲノム重複の謎に挑む〜
大森 義裕
長浜バイオ大学 ゲノム機能科学研究室 教授
世界初の全ゲノム解読、ライバルに勝った
大森義裕・長浜バイオ大学教授らは、キンギョの全ゲノムを解読し、2019年にScience Advancesに論文を発表した。遺伝子の数は約7万個あり、これまで脊椎動物のモデルとして広く使われてきたゼブラフィッシュの約2万6千個より多く多様性もあるため、人間の病気の研究や、進化の研究などの糸口にもなると期待されている。
さまざまな生き物を家で飼っていた子ども時代だったという大森教授。「キンギョも、そのころからものすごく好きだったんですよ」と話す。

キンギョを研究対象として認識したのは、米国でのポスドク時代に現地のショッピングセンターで出目金や琉金などのキンギョが、たくさん売られているのに出会った時だった。
当時、ゼブラフィッシュの変異体を研究していたが、「キンギョでも、品種の背景にある原因の遺伝子をつきとめられるはずだ」と気づいた。
2007年に帰国後、キンギョの研究で実績のある愛知県水産試験場を早速訪ね、研究を始めた。しかし、キンギョはゲノムの解読がゼブラフィッシュよりはるかに難しく、理屈では解読できるとわかっていても、当時の技術では、すぐには手が出せなかったそうだ。
2010年代半ばになって、急速に技術革新が進んでいた次世代シーケンサーを使い、米国国立衛生研究所(NIH)や愛知県水産試験場と共同で、全ゲノム解読に着手。中国の強力なライバル2チームを振り切って最初に解読することに成功した。
実験動物としても優れた特徴を持つキンギョ
キンギョは中国のフナ由来の観賞魚で、約千年にも及ぶ育種の歴史がある。赤、黒、黄などの体色、ショートボディや背びれ欠損などの体型、ロングテールや蝶尾など尾びれの形、出目や肉こぶなど頭部の形など、さまざまな特徴を持つ200以上の品種がある。
全ゲノムが解読できたおかげで、これらの品種が、どんな遺伝子の違いによって生じているか比較的簡単に調べられるようになった。先進ゲノム解析研究推進プラットフォーム(PAGS)の支援で、金魚48匹分のゲノムを解析し、品種ごとに変異のある遺伝子の場所を探しだした。人間の病気と遺伝子の関連を探るために開発されたゲノムワイド関連解析(GWAS)という方法を使っている。
「もう次々わかってくる。1000年の歴史の中で蓄積されてきた品種のもとになっている変異を、ゲノム配列を手元に持っている僕らだけが最初に見つけられるわけですから、毎日驚きの日々で、興奮しましたね」
全ゲノム解読の成果で、キンギョの品種改良がしやすくなるだけでなく、実験動物としての価値も再認識されている。

キンギョは、人の病気のモデルとしても役立つ。たとえば出目金の眼が大きくなる仕組みは、人の緑内障の発症機構と似ているので、出目金を使って緑内障を解明する手がかりを得ることができるかもしれない。ゼブラフィッシュより、多様な品種があるので、より幅広い病気をカバーできそうだ。
また、ゼブラフィッシュより、キンギョは1000倍以上の重さになることも利点となる。特定の組織の細胞を集めたいときや、電極を刺す実験、手術が必要な実験などがやりやすくなるからだ。
そして、進化の研究でも重要な手がかりを与えてくれる。
人間など脊椎動物の祖先は、全ゲノム重複と呼ばれる現象を約5億年前に起こしたことが知られている(図)。これはすべての遺伝子が倍に増える現象で、進化の原動力になっていると考えられている。増えた遺伝子の一部が、新しい発現パターンを得たり、新たな機能を獲得したりすることで、環境に適応する力が増すからだ。
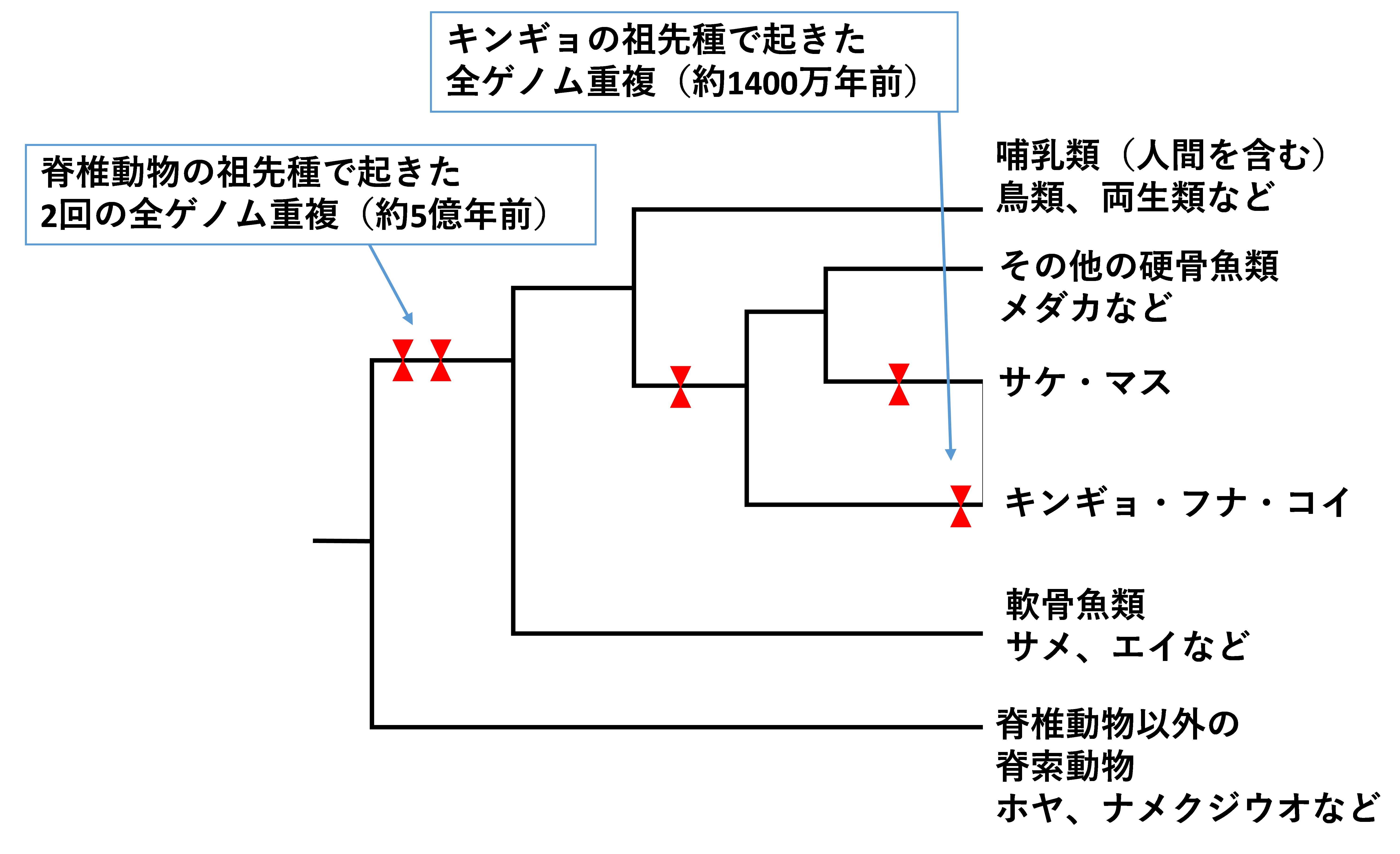
図 5億年前の脊椎動物の祖先種で2回の全ゲノム重複が起こったとされている。コイ・フナについては約1400万年前にその祖先種で全ゲノム重複が起こったと考えられる。樹形図のなかで全ゲノム重複が起こったと考えられている個所を赤三角で示した。
ただし、5億年前の全ゲノム重複は、あまりに古い時代に起きているので、現在の動物のゲノムからその痕跡や仕組みを詳しく調べるのは難しかった。
一方、キンギョは、全ゲノム解読の結果、約1400万年前に全ゲノム重複を起こしていたことがわかった。進化の時間スケールからみれば、まだつい最近の出来事だ。キンギョのゲノムを詳しく調べることで、全ゲノム重複を起こした後に、遺伝子がどのように進化するのか知ることができると期待されている。
キンギョにこれだけ多様な形や色を持つ品種があるのも、全ゲノム重複のおかげで、他の魚類の約2倍の遺伝子をもっていることが素地になっている。
PAGSが裾野を広げてくれる
この全ゲノム重複のため、キンギョのゲノム研究は難しかった。長いDNA(ロングリード)を一度に読める次世代DNAシーケンサーが2010年代に開発され、ようやく解読にこぎつけた。
全ゲノムを解読する時、従来のシーケンサーは小さなDNA断片を組み合わせてゲノムの全体像を再構成するに対し、ロングリードの次世代シーケンサーは、一つ一つの断片が大きいので、全体像を読み解くのが簡単になる。
大森教授は、さまざまな品種のキンギョのゲノム解析や、シングルセル解析(1細胞ごとに全遺伝子の発現量を定量的に解析する)などでPAGSの支援を受け、キンギョの病気と人間の病気の関連や、キンギョの視覚の進化などの研究を続けている。

「最先端の技術を持つ研究者と共同研究できる『つて』を、誰もが持っているわけではありません。我々のような全国に散らばっている小規模な大学の研究者でも、最先端の技術で支援してもらえるPAGSの仕組みはとても助かります」
次世代DNAシーケンサーを上手く使うには、試料をとる際にも、ピペットの使い方や、試料の攪拌方法などに細かなノウハウがある。「PAGSなら、論文に書いてないようなところまで、教えてもらえる。外部委託では、そこまでの手厚い支援は期待できません」データを解析する段階でも、類似した事例の経験を重ねているPAGSの研究者が支援してくれるのは心強い。
「米国や中国の研究者と競争するなかで、このような支援がなければボロ負けですよ」とも大森教授は言う。PAGSの利用を検討している研究者には「新しい技術はどんどん取り入れていくべきだと思います。ただし解析を丸投げするのではなく、自分たちはここまでできるのだけど、この先のステップは協力してください、というスタンスで相談した方が、後で論文を書く段階でも理解が違ってきますし、将来発展的な研究を行う可能性も高まってくると思います。」とアドバイスしている。
(2022年7月21日インタビュー)
*感染対策を行い、取材・撮影を行いました。
 大森 義裕(おおもり・よしひろ)
大森 義裕(おおもり・よしひろ)
長浜バイオ大学 ゲノム機能科学研究室 教授
広島県呉市出身。1990年 修道高等学校卒業。1996年 京都大学 大学院 工学研科 合成生物化学専攻 修了(田中渥夫 研究室)。2003年 東京大学 医科学研究所、医学博士取得(菅野純夫 研究室)。2004年 ハーバード大学医学部 眼科 博士研究員(Jarema Malicki研究室)。2009年 大阪バイオサイエンス研究所 発生生物学部門 副部長(古川貴久 研究室)。2010年 JSTさきがけ研究者 兼任。2013年 大阪大学 蛋白質研究所 分子発生学研究室 准教授。2019年より現職。
支援利用者インタビュー
【イベントお知らせ】📢先進ゲノム支援プラットフォームが情報解析講習会(中級)を開催します!
— 生命科学連携推進協議会 (@platform_imsut) January 29, 2026
◇日時:2/20(金)10:00~16:00 (Zoom)
◇参加費無料
※ご参加には受講登録が必要です。
登録締め切り🔔【 2/9(月)】
ご登録・詳細はこちら▶️https://t.co/noZxGChOB1 https://t.co/TQO8qrM3HH







